
国家药监局6月20日发布关于15批次药品不符合规定的通告。
经广州市药品检验所等8家药品检验机构检验,标示为修正药业集团股份有限公司等15家企业生产的妇康片等15批次药品不符合规定。现将相关情况通告如下:
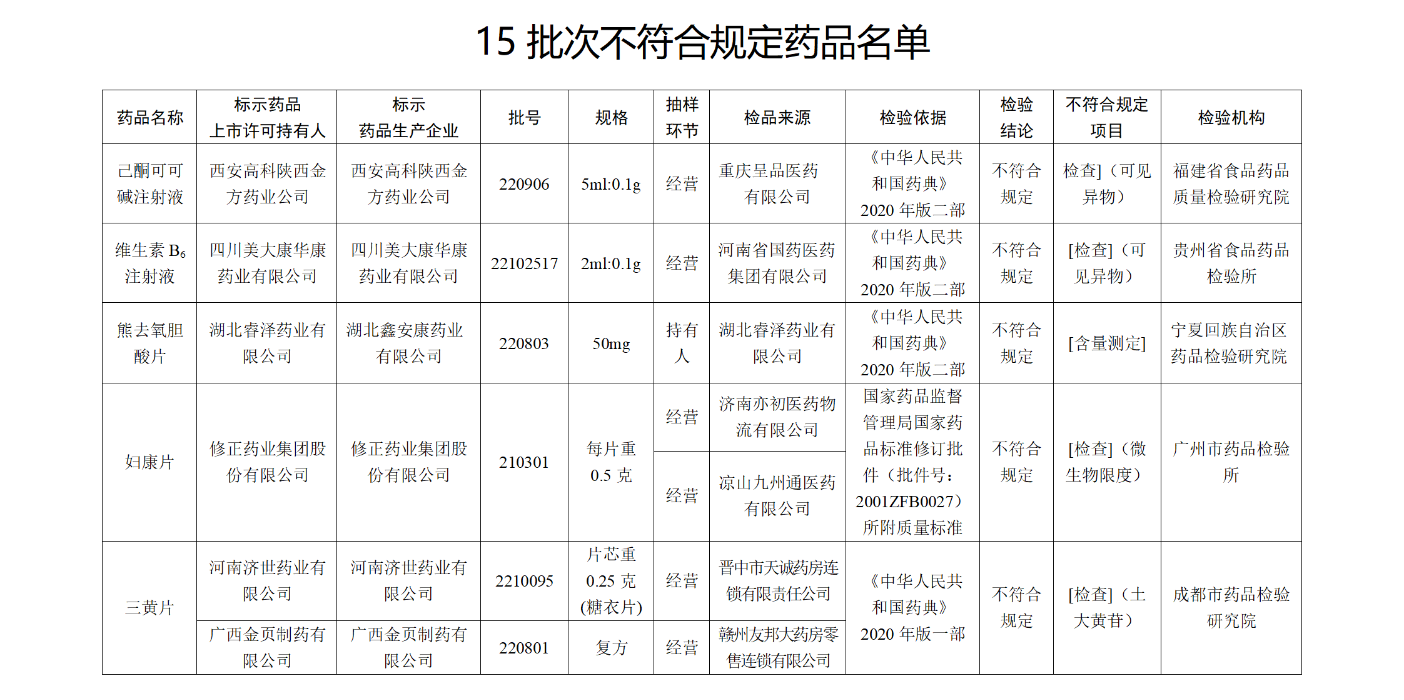
经福建省食品药品质量检验研究院检验,标示为西安高科陕西金方药业公司生产的1批次己酮可可碱注射液 不符合规定,不符合规定项目为可见异物。
经贵州省食品药品检验所检验,标示为四川美大康华康药业有限公司生产的1批次维生素B6注射液 不符合规定,不符合规定项目为可见异物 。
经宁夏回族自治区药品检验研究院检验,标示为湖北睿泽药业有限公司委托湖北鑫安康药业有限公司生产的1批次熊去氧胆酸片 不符合规定,不符合规定项目为含量测定。
经广州市药品检验所检验,标示为修正药业集团股份有限公司生产的1批次妇康片 不符合规定,不符合规定项目为微生物限度。
经成都市药品检验研究院检验,标示为河南济世药业有限公司、广西金页制药有限公司生产的2批次三黄片 不符合规定,不符合规定项目为土大黄苷。
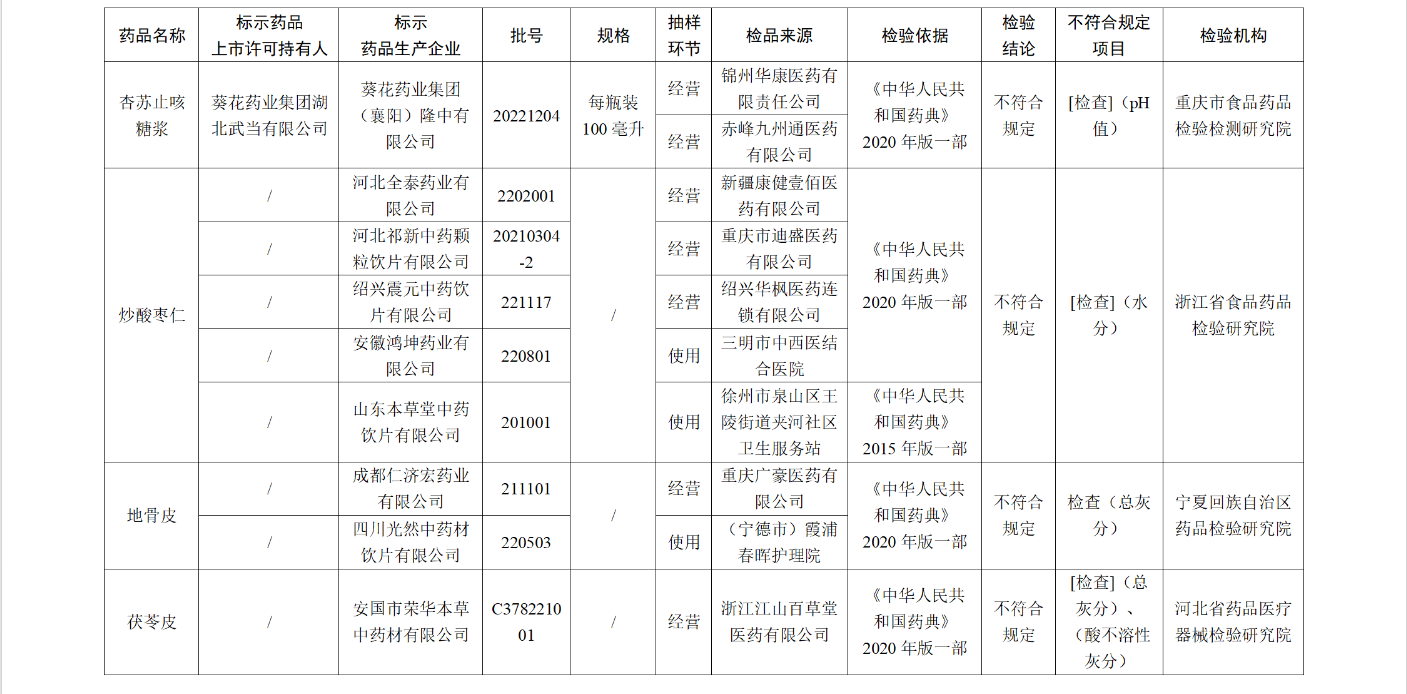
经重庆市食品药品检验检测研究院检验,标示为葵花药业集团湖北武当有限公司委托葵花药业集团(襄阳)隆中有限公司生产的1批次杏苏止咳糖浆 不符合规定,不符合规定项目为pH值。
经浙江省食品药品检验研究院检验,标示为河北全泰药业有限公司、河北祁新中药颗粒饮片有限公司、绍兴震元中药饮片有限公司、安徽鸿坤药业有限公司、山东本草堂中药饮片有限公司生产的5批次炒酸枣仁 不符合规定,不符合规定项目为水分。
经宁夏回族自治区药品检验研究院检验,标示为成都仁济宏药业有限公司、四川光然中药材饮片有限公司生产的2批次地骨皮 不符合规定,不符合规定项目为总灰分。
经河北省药品医疗器械检验研究院检验,标示为安国市荣华本草中药材有限公司生产的1批次茯苓皮 不符合规定,不符合规定项目包括总灰分和酸不溶性灰分。
不符合规定项目的小知识
一、可见异物系指存在于注射剂、眼用液体制剂中,在规定的目视条件下能够观察到的不溶性物质,其粒径或长度通常大于50微米。
二、含量测定系指用规定的试验方法测定原料及制剂中有效成分的含量,一般可采用化学、仪器或生物测定方法。
三、微生物限度系对非直接进入人体内环境的药物制剂的微生物控制要求。由于此类药物制剂的用药风险略低,可以允许一定数量的微生物存在,但不得检出一些条件致病菌。微生物限度分为计数检查和控制菌检查两部分。
四、土大黄苷主要考察含大黄的药品中是否存在土大黄的情况。
五、pH值是氢离子浓度指数,作为酸碱程度的衡量指标。
六、水分系指药品中的含水量。水分偏高通常与工艺、包装不当以及储运环境等因素有关。
七、总灰分测定的目的是检测中药的纯净程度。
八、酸不溶性灰分指标主要用于检测中药中泥土、沙石等杂质的含量
对不符合规定药品
国家药监局表示,对上述不符合规定药品,药品监督管理部门已要求相关企业和单位采取暂停销售使用、召回等风险控制措施 ,对不符合规定原因开展调查并切实进行整改。
国家药品监督管理局要求相关省级药品监督管理部门依据《中华人民共和国药品管理法》,组织对上述企业和单位存在的涉嫌违法行为立案调查,并按规定公开查处结果。
附:15批次不符合规定药品名单
(内容来源于:国家药监局)